Что называют электрическим током жидкостях. Электрический ток в жидкостях: его происхождение, количественные и качественные характеристики. Катод и анод. Катионы и анионы
>>Физика: Электрический ток в жидкостях
Жидкости, как и твердые тела, могут быть диэлектриками, проводниками и полупроводниками. К числу диэлектриков относится дистиллированная вода, к проводникам - растворы и расплавы электролитов: кислот, щелочей и солей. Жидкими полупроводниками являются расплавленный селен, расплавы сульфидов и др.
Электролитическая диссоциация.
При растворении электролитов под влиянием электрического поля полярных молекул воды происходит распад молекул электролитов на ионы. Этот процесс называется электролитической диссоциацией
.
Степень диссоциации
, т. е. доля в растворенном веществе молекул, распавшихся на ионы, зависит от температуры, концентрации раствора и электрических свойств растворителя. С увеличением температуры степень диссоциации возрастает и, следовательно, увеличивается концентрация положительно и отрицательно заряженных ионов.
Ионы разных знаков при встрече могут снова объединиться в нейтральные молекулы - рекомбинироватъ
. При неизменных условиях в растворе устанавливается динамическое равновесие, при котором число молекул, распадающихся за секунду на ионы, равно числу пар ионов, которые за то же время вновь объединяются в нейтральные молекулы.
Ионная проводимость.
Носителями заряда в водных растворах или расплавах электролитов являются положительно и отрицательно заряженные ионы.
Если сосуд с раствором электролита включить в электрическую цепь, то отрицательные ионы начнут двигаться к положительному электроду - аноду, а положительные - к отрицательному - катоду. В результате установится электрический ток. Поскольку перенос заряда в водных растворах или расплавах электролитов осуществляется ионами, такую проводимость называют ионной
.
Жидкости могут обладать и электронной проводимостью . Такой проводимостью обладают, например, жидкие металлы.
Электролиз.
При ионной проводимости прохождение тока связано с переносом вещества. На электродах происходит выделение веществ, входящих в состав электролитов. На аноде отрицательно заряженные ионы отдают свои лишние электроны (в химии это называется окислительной реакцией), а на катоде положительные ионы получают недостающие электроны (восстановительная реакция). Процесс выделения на электроде вещества, связанный с окислительно-восстановительными реакциями, называют электролизом
.
Применение электролиза.
Электролиз широко применяют в технике для различных целей. Электролитическим путем покрывают поверхность одного металла тонким слоем другого (никелирование, хромирование, омеднение
и т. п.). Это прочное покрытие защищает поверхность от коррозии.
Если обеспечить хорошее отслаивание электролитического покрытия от поверхности, на которую осаждается металл (этого достигают, например, нанося на поверхность графит), то можно получить копию с рельефной поверхности.
В полиграфической промышленности такие копии (стереотипы) получают с матриц (оттиск набора на пластичном материале), для чего осаждают на матрицах толстый слой железа или другого вещества. Это позволяет воспроизвести набор в нужном количестве экземпляров. Если раньше тираж книги ограничивался числом оттисков, которые можно получить с одного набора (при печатании набор постепенно стирается), то сейчас использование стереотипов позволяет значительно увеличить тираж. Правда, в настоящее время с помощью электролиза получают стереотипы только для книг высококачественной печати.
Процесс получения отслаиваемых покрытий - гальванопластика
- был разработан русским ученым Б. С. Якоби (1801-1874), который в 1836 г. применил этот способ для изготовления полых фигур для Исаакиевского собора в Санкт-Петербурге.
При помощи электролиза осуществляют очистку металлов от примесей. Так, полученную из руды неочищенную медь отливают в форме толстых листов, которые затем помещают в ванну в качестве анодов. При электролизе медь анода растворяется, примеси, содержащие ценные и редкие металлы, выпадают на дно, а на катоде оседает чистая медь.
При помощи электролиза получают алюминий из расплава бокситов. Именно этот способ получения алюминия сделал его дешевым и наряду с железом самым распространенным в технике и быту.
С помощью электролиза получают электронные платы, служащие основой всех электронных изделий. На диэлектрик наклеивают тонкую медную пластину, на которую наносят особой краской сложную картину соединяющих проводов. Затем пластину помещают в электролит, где вытравливаются незакрытые краской участки медного слоя. После этого краска смывается и на плате появляются детали микросхемы.
В растворах и расплавах электролитов свободные электрические заряды появляются за счет распада на ионы нейтральных молекул. Движение ионов в поле означает перенос вещества. Этот процесс широко используется на практике (электролиз).
???
1. Что называют электролитической диссоциацией?
2. Почему при прохождении тока по раствору электролита происходит перенос вещества, а при прохождении по металлическому проводнику перенос вещества не происходит?
3. В чем состоит сходство и различие собственной проводимости у полупроводников и у растворов электролитов?
Г.Я.Мякишев, Б.Б.Буховцев, Н.Н.Сотский, Физика 10 класс
Скачать календарно-тематическое планирование по физике , ответы на тесты, задания и ответы школьнику, книги и учебники , курсы учителю по физике для 10 класса
Содержание урока конспект урока опорный каркас презентация урока акселеративные методы интерактивные технологии Практика задачи и упражнения самопроверка практикумы, тренинги, кейсы, квесты домашние задания дискуссионные вопросы риторические вопросы от учеников Иллюстрации аудио-, видеоклипы и мультимедиа фотографии, картинки графики, таблицы, схемы юмор, анекдоты, приколы, комиксы притчи, поговорки, кроссворды, цитаты Дополнения рефераты статьи фишки для любознательных шпаргалки учебники основные и дополнительные словарь терминов прочие Совершенствование учебников и уроков исправление ошибок в учебнике обновление фрагмента в учебнике элементы новаторства на уроке замена устаревших знаний новыми Только для учителей идеальные уроки календарный план на год методические рекомендации программы обсуждения Интегрированные урокиЕсли у вас есть исправления или предложения к данному уроку,
Жидкости, как и твердые тела, могут быть проводниками, полупроводниками и диэлектриками. В этом уроке речь пойдет о жидкостях-проводниках. Причем не о жидкостях с электронной проводимостью (расплавленные металлы), а о жидкостях-проводниках второго рода (растворы и расплавы солей, кислот, оснований). Тип проводимости таких проводников - ионный.
Определение . Проводники второго рода - такие проводники, в которых при протекании тока происходят химические процессы.
Для лучшего понимания процесса проводимости тока в жидкостях, можно представить следующий опыт: В ванну с водой поместили два электрода, подключенные к источнику тока, в цепи в качестве индикатора тока можно взять лампочку. Если замкнуть такую цепь, лампа гореть не будет, что означает отсутствие тока, а это значит, что в цепи есть разрыв, и вода сама по себе ток не проводит. Но если в ванную поместить некоторое количество - поваренной соли - и повторить замыкание, то лампочка загорится. Это значит, что в ванной между катодом и анодом начали двигаться свободные носители заряда, в данном случае ионы (рис. 1).

Рис. 1. Схема опыта
Проводимость электролитов
Откуда во втором случае берутся свободные заряды? Как было сказано в одном из предыдущих уроков, некоторые диэлектрики - полярные. Вода имеет как раз-таки полярные молекулы (рис. 2).

Рис. 2. Полярность молекулы воды
При внесении в воду соли молекулы воды ориентируются таким образом, что их отрицательные полюса находятся возле натрия, положительные - возле хлора. В результате взаимодействий между зарядами молекулы воды разрывают молекулы соли на пары разноименных ионов. Ион натрия имеет положительный заряд, ион хлора - отрицательный (рис. 3). Именно эти ионы и будут двигаться между электродами под действием электрического поля.

Рис. 3. Схема образования свободных ионов
При подходе ионов натрия к катоду он получает свои недостающие электроны, ионы хлора при достижении анода отдают свои.
Электролиз
Так как протекание тока в жидкостях связано с переносом вещества, при таком токе имеет место процесс электролиза.
Определение. Электролиз - процесс, связанный с окислительно-восстановительными реакциями, при которых на электродах выделяется вещество.
Вещества, которые в результате подобных расщеплений обеспечивают ионную проводимость, называются электролитами. Такое название предложил английский физик Майкл Фарадей (рис. 4).
Электролиз позволяет получать из растворов вещества в достаточно чистом виде, поэтому его применяют для получения редких материалов, как натрий, кальций… в чистом виде. Этим занимается так называемая электролитическая металлургия.
Законы Фарадея
В первой работе по электролизу 1833 года Фарадей представил свои два закона электролиза. В первом речь шла о массе вещества, выделяющегося на электродах:
Первый закон Фарадея гласит, что эта масса пропорциональна заряду, прошедшему через электролит:
Здесь роль коэффициента пропорциональности играет величина - электрохимический эквивалент. Это табличная величина, которая уникальна для каждого электролита и является его главной характеристикой. Размерность электрохимического эквивалента:
![]()
Физический смысл электрохимического эквивалента - масса, выделившаяся на электроде при прохождении через электролит количества электричества в 1 Кл.
Если вспомнить формулы из темы о постоянном токе:
То можно представить первый закон Фарадея в виде:
Второй закон Фарадея непосредственно касается измерения электрохимического эквивалента через другие константы для конкретно взятого электролита:
Здесь: - молярная масса электролита; - элементарный заряд; - валентность электролита; - число Авогадро.
Величина называется химическим эквивалентом электролита. То есть, для того чтобы знать электрохимический эквивалент, достаточно знать химический эквивалент, остальные составляющие формулы являются мировыми константами.
Исходя из второго закона Фарадея, первый закон можно представить в виде:
![]()
Фарадей предложил терминологию этих ионов по признаку того электрода, к которому они движутся. Положительные ионы называются катионами, потому что они движутся к отрицательно заряженному катоду, отрицательные заряды называются анионами как движущиеся к аноду.
Вышеописанное действие воды по разрыву молекулы на два иона называется электролитической диссоциацией.
Помимо растворов, проводниками второго рода могут быть и расплавы. В этом случае наличие свободных ионов достигается тем, что при высокой температуре начинаются очень активные молекулярные движения и колебания, в результате которых и происходит разрушение молекул на ионы.
Практическое применение электролиза
Первое практическое применение электролиза произошло в 1838 году русским ученым Якоби. С помощью электролиза он получил оттиск фигур для Исаакиевского собора. Такое применение электролиза получило название гальванопластика. Другой сферой применения является гальваностегия - покрытие одного металла другим (хромирование, никелирование, золочение и т.д., рис. 5)
- Fatyf.narod.ru ().
- ХиМиК ().
- Ens.tpu.ru ().
Домашнее задание
- Что такое электролиты?
- Какие существуют два принципиально разных типа жидкостей, в которых может протекать электрический ток?
- Какие могут быть механизмы образования свободных носителей зарядов?
- *Почему масса, выделившаяся на электроде, пропорциональна заряду?
Всем знакомо определение электрического тока. Оно представляется как направленное движение заряженных частиц. Подобное движение в различных средах имеет принципиальные отличия. Как основной пример этого явления можно представить течение и распространение электрического тока в жидкостях . Такие явления характеризуются различными свойствами и серьезно отличаются от упорядоченного движения заряженных частиц, которое происходит в обычных условиях не под воздействием различных жидкостей.
Рисунок 1. Электрический ток в жидкостях. Автор24 - интернет-биржа студенческих работ
Формирование электрического тока в жидкостях
Несмотря на то, что процесс проводимости электрического тока осуществляется посредством металлических приборов (проводников), ток в жидкостях лежит в зависимости от движения заряженных ионов, которые приобрели или потеряли по некой определенной причине подобные атомы и молекулы. Показателем такого движения выступает изменение свойств определенного вещества, где проходят ионы. Таким образом, нужно опираться на основное определение электрического тока, чтобы сформировать специфическое понятие формирования тока в различных жидкостях. Определено, что разложение отрицательно заряженных ионов способствует движению в область источника тока с положительными значениями. Положительно заряженные ионы в таких процессах будут двигаться в противоположном направлении – к отрицательному источнику тока.
Жидкие проводники делятся на три основных типа:
- полупроводники;
- диэлектрики;
- проводники.
Определение 1
Электролитическая диссоциация - процесс разложения молекул определенного раствора на отрицательные и положительные заряженные ионы.
Можно установить, что электроток в жидкостях может возникать после изменения состава и химического свойства используемых жидкостей. Это напрочь противоречит теории распространения электрического тока иными способами при использовании обычного металлического проводника.
Опыты Фарадея и электролиз
Течение электрического тока в жидкостях – это продукт процесса перемещения заряженных ионов. Проблемы, связанные с возникновение и распространением электротока в жидкостях, стали причиной изучения знаменитого ученого Майкла Фарадея. Он при помощи многочисленных практических исследований смог найти доказательства, что масса вещества, выделяемая в процессе электролиза, зависит от количества времени и электричества. При этом имеет значение время, в течение которого проводились эксперименты.
Также ученый смог выяснить, что в процессе электролиза при выделении определенного количества вещества необходимо одинаковое количество электрических зарядов. Это количество удалось точно установить и зафиксировать в постоянной величине, которая получила название числа Фарадея.
В жидкостях электрический ток имеет иные условия распространения. Он взаимодействует с молекулами воды. Они в значительной степени затрудняют все передвижения ионов, что не наблюдалось в опытах с использование обычного металлического проводника. Из этого следует, что образование тока при электролитических реакциях будет не столь большим. Однако при увеличении температуры раствора проводимость постепенно увеличивается. Это означает, что напряжение электрического тока растет. Также в процессе электролиза было замечено, что вероятность распада определенной молекулы на отрицательные или положительные заряды ионов увеличивается из-за большого числа молекул используемого вещества или растворителя. При насыщении раствора ионами сверх определенной нормы, происходит обратный процесс. Проводимость раствора вновь начинает снижаться.
В настоящее время процесс электролиза нашел свое применения во многих областях и сферах науки и на производстве. Промышленные предприятия его используют при получении или обработке металла. Электрохимические реакции участвуют в:
- электролизе солей;
- гальванике;
- полировке поверхностей;
- иных окислительно-восстановительных процессах.
Электрический ток в вакууме и жидкостях
Распространение электрического тока в жидкостях и иных средах представляет собой довольно сложный процесс, который имеет собственные характеристики, особенности и свойства. Дело в том, что в подобных средах полностью отсутствуют заряды в телах, поэтому их принято называть диэлектриками. Главной целью исследований стало то, чтобы создать такие условия, при которых атомы и молекулы могли бы начать свое движения и процесс образования электрического тока начался. Для этого принято использовать специальные механизмы или устройства. Основным элементом таких модульных устройств стали проводники в виде металлических пластин.
Для определения основных параметров тока необходимо воспользоваться известными теориями и формулами. Самым распространенным являются закон Ома. Он выступает в роли универсальной амперной характеристики, где осуществляется принцип зависимости тока от напряжения. Напомним, что напряжение измеряется в единице Ампер.
Для проведения опытов с водой и солью необходимо подготовить сосуд с соленой водой. Это даст практическое и визуальное представление о процессах, которые происходят при образовании электрического тока в жидкостях. Также установка должна содержать электроды прямоугольной формы и источники питания. Для полномасштабной подготовки к опытам нужно иметь амперную установку. Она поможет провести энергию от сети питания к электродам.
В роли проводников будут выступать металлические пластины. Их опускают в используемую жидкость, а затем подключается напряжение. Сразу начинается перемещение частиц. Оно проходит в хаотичном режиме. При возникновении магнитного поля между проводниками все процессе движения частиц упорядочиваются.
Ионы начинают меняться зарядами и объединяться. Таким образом, катоды становятся анодами, а аноды – катодами. В этом процессе необходимо также учитывать еще несколько важных факторов:
- уровень диссоциации;
- температура;
- электрическое сопротивление;
- использование переменного или постоянного тока.
В конце эксперимента происходит образование слоя соли на пластинах.
Электрический ток в газах
Носители заряда: электроны, положительные ионы, отрицательные ионы.
Носители заряда возникают в газе в результате ионизации: вследствие облучения газа, либо столкновений частиц нагретого газа друг с другом.
Ионизация электронным ударом.
A_{поля}=eEl
e=1,6\cdot 10^{19}Кл ;
E - направление поля;
l - длина свободного пробега между двумя последовательными столкновениями электрона с атомами газа.
A_{поля}=eEl\geq W - условие ионизации
W - энергия ионизации, т.е. энергия, необходимая для того, чтобы вырвать из атома электрон

Число электронов увеличивается в геометрической прогрессии, в результате возникает электронная лавина, а следовательно разряд в газе.
Электрический ток в жидкости
Жидкости так же, как и твердые тела могут быть диэлектриками, проводниками и полупроводниками. К числу диэлектриков относится дистиллированная вода, к проводникам - растворы электролитов: кислот, щелочей, солей и расплавы металлов. Жидкими полупроводниками являются расплавленный селен, расплавы сульфидов.
Электролитическая диссоциация
При растворении электролитов под влиянием электрического поля полярных молекул воды происходит распад молекул электролитов на ионы. Например, CuSO_{4}\rightarrow Cu^{2+}+SO^{2-}_{4} .
Наряду с диссоциацией идет обратный процесс - рекомбинация , т.е. объединение ионов противоположных знаков в нейтральные молекулы.
Носителями электричества в растворах электролитов являются ионы. Такая проводимость называется ионной .
Электролиз
Если в ванну с раствором электролита поместить электроды и пустить ток, то отрицательные ионы будут двигаться к положительному электроду, а положительные - к отрицательному.
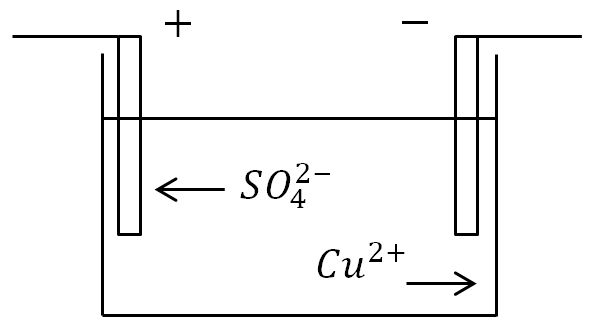
На аноде (положительном электроде) отрицательно заряженные ионы отдают лишние электроны (окислительная реакция), а на катоде (отрицательном электроде) положительные ионы получают недостающие электроны (восстановительная реакция).
Определение. Процесс выделения на электродах веществ, связанный с окислительно-восстановительными реакциями называется электролизом.
Законы Фарадея
I. Масса вещества, которая выделяется на электроде, прямо пропорциональна заряду, протекшему через электролит:
m=kq
k - электрохимический эквивалент вещества.
q=I\Delta t , тогда
m=kI\Delta t
k=\frac{1}{F}\frac{\mu}{n}
\frac{\mu}{n} - химический эквивалент вещества;
\mu - молярная масса;
n - валентность
Электрохимические эквиваленты веществ пропорциональны химическим.
F - постоянная Фарадея;
К жидкостям, являющимся проводниками, относятся расплавы и растворы электролитов, т.е. солей, кислот и щелочей.
При растворении электролитов в воде происходит распад их молекул на ионы – электролитическая диссоциация. Степень диссоциации, т.е. доля в растворенном веществе молекул, распавшихся на ионы, зависит от температуры, концентрации раствора и электрических свойств растворителя. С увеличением температуры степень диссоциации возрастает и, следовательно, увеличивается концентрация положительно и отрицательно заряженных ионов. Ионы разных знаков при встрече могу снова объединиться в нейтральные молекулы. Такой процесс называется рекомбинация. При неизменных условиях в растворе устанавливается динамическое равновесие, при котором число молекул, распадающихся за секунду на ионы, равно числу пар ионов, которые за то же время вновь объединяются в нейтральные молекулы.
Т.о., свободными носителями зарядов в проводящих жидкостях являются положительные и отрицательные ионы. Если в жидкость поместить электроды подключенные к источнику тока, то эти ионы начнут придут в движение. Один из электродов подключен к отрицательному полюсу источника тока – он называется катод – другой подключен к положительному - анод. При подключении к источнику тока ионы в растворе электролита отрицательные ионы начинают двигаться к положительному электроду (аноду), а положительные – соответственно к отрицательному (катоду). То есть установится электрический ток. Такую проводимость в жидкостях называют ионной, так как носителями заряда являются ионы.
При прохождении тока через раствор электролита на электродах происходит выделение вещества, связанное с окислительно-восстановительными реакциями. На аноде отрицательно заряженные ионы отдают свои лишние электроны (окислительная реакция), а на катоде положительные ионы принимают недостающие электроны (восстановительная реакция). Такой процесс называется электролизом.
При электролизе на электродах происходит выделение вещества. Зависимость массы выделившегося вещества m от силы тока, времени прохождения тока и самого вещества установил М.Фарадей. Этот закон можно получить теоретически. Итак, масса выделившегося вещества равна произведению массы одного иона m i на число ионов N i , достигших электрода за время Dt. Масса иона согласно формуле количества вещества равна m i =M/N a , где M – молярная масса вещества, N a – постоянная Авогадро. Число ионов, достигших электрода, равно N i =Dq/q i , где Dq – заряд, прошедший электролит за время Dt (Dq=I*Dt), q i – заряд иона, который определяется валентностью атома (q i = n*e, где n – валентность атома, e – элементарный заряд). При подстановке этих формул получаем, что m=M/(neN a)*IDt. Если обозначить через k (коэффициент пропорциональности) =M/(neN a), то имеем m=kIDt. Это математическая запись первого закона Фарадея – одного из законов электролиза. Масса вещества, выделившегося на электроде за время Dt при прохождении электрического тока, пропорциональна силе тока и этому промежутку времени. Величину k называют электрохимическим эквивалентом данного вещества, который численно равен массе вещества, выделившегося на электродах, при переносе ионами заряда, равного 1 Кл. [k]= 1 кг/Кл. k = M/(neN a) = 1/F*M/n , где F – постоянная Фарадея. F=eN a =9,65*10 4 Кл/моль. Выведенная формула k=(1/F)*(M/n) является вторым законом Фарадея.
Электролиз широко применяется в технике для различных целей, например,так покрывают поверхность одного металла тонким слоем другого (никелирование, хромирование, омеднение и др.). Если обеспечить хорошее отслаивание электролитического покрытия от поверхности, то можно получить копию рельефа поверхности. Этот процесс называется гальванопластика. Также при помощи электролиза осуществляют очистку металлов от примесей, например, толстые листы неочищенной меди, полученной из руды, помещают в ванну в качестве анода. В процессе электролиза медь растворяется, примеси выпадают на дно, а на катоде оседает чистая медь. С помощью электролиза ещё получают электронные платы. На диэлектрик наклеивают тонкую сложную картину соединяющих проводов, затем помещают пластину в электролит, где вытравливаются незакрытые краской участки медного слоя. После этого краска смывается и на плате появляются детали микросхемы.
